2023-04-14
清华大学杜亚楠和安徽省立医院朱小玉:造血干细胞与间充质干细胞三维微支架内共培养构建可注射骨髓微环境促进辐照损伤后造血重建|BAM
。近期,清华大学医学院杜亚楠教授和中国科学技术大学附属第一医院(安徽省立医院)朱小玉教授在科爱出版创办的期刊Bioactive Materials上联合发表文章:造血干细胞(HSPCs)与间充质干细胞(MSCs)三维微支架内共培养构建可注射骨髓微环境促进急性致死性辐射小鼠的造血重建。天然骨髓微环境由三维结构和支持细胞组成,作者受其启发设计合成了一种新型可注射可降解的三维生物支架材料,并将HSPCs和MSCs在三维微支架内共培养实现体外骨髓微环境(Microniche)的构建,通过骨髓腔递送的方式以最低的造血干细胞剂量重建致死辐照剂量小鼠的血液系统,为急性辐射综合征造血亚综合征(h-ARS)的临床治疗提供新方案。
1. 研究内容简介
急性辐射综合征造血亚综合征(h-ARS)是指短时间内意外暴露于单次高剂量辐射导致的骨髓微环境损伤,并伴有骨髓造血衰竭,从而导致出血、感染和死亡的重大风险。此外,辐射导致的造血损伤不仅造成造血干细胞的损伤和衰竭,同时伴随着骨髓基质细胞的损伤。临床上,已有多种药物如促血小板生成、凝血酶和免疫调节剂用于治疗h-ARS。然而,多数药物只是对于低剂量辐射损伤起到缓解作用,对高剂量辐射损伤的治疗仍不理想。
受到天然骨髓微环境组成的启发,作者通过仿生天然骨髓微环境的三维结构和机械参数(即孔径和硬度),体外构建了基质硬度和微观孔径可调的的仿生微支架。此外,作者优化了微支架的可注射性和可降解性,并将其集成到微支架阵列芯片中,从而有利于细胞接种、培养和移植。基于仿生微支架,采用HSPCs与MSCs共培养,构建维持干细胞活力和多细胞相互作用的可注射型仿生微环境(Microniche),并将Microniche作为整体递送至骨髓腔,以含有最低剂量HSPCs的Microniche重建致死剂量辐照小鼠的血液系统(图1)。
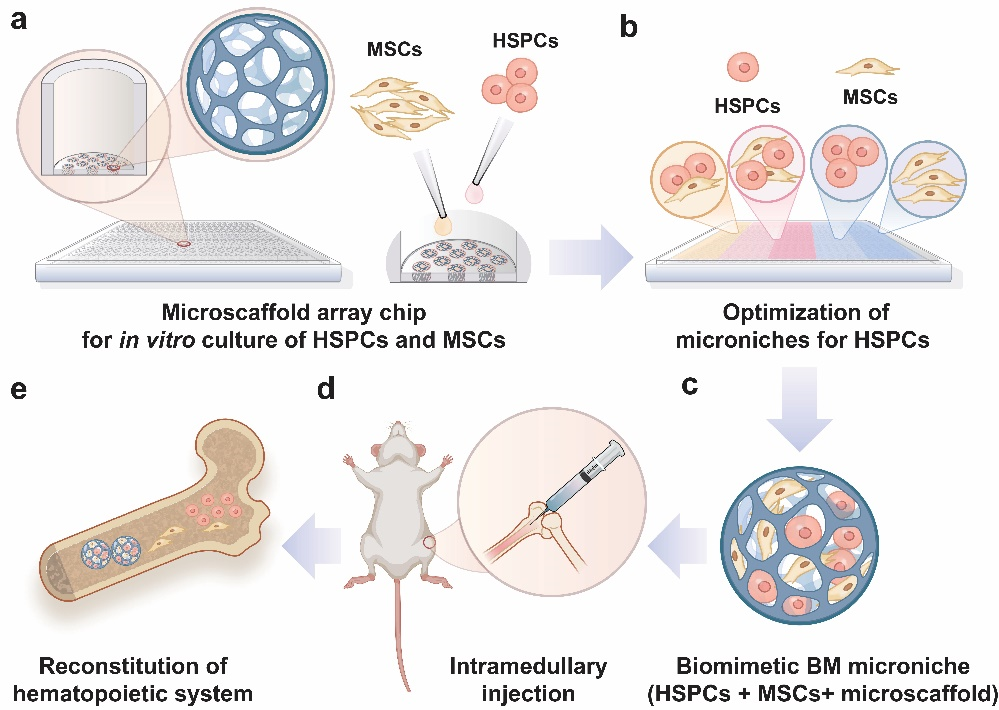
图1:微支架阵列芯片的构建、HSPCs和MSCs体外共培养以及h-ARS移植治疗的整体流程示意图。a,基质硬度和微观孔径可调的仿生微支架阵列芯片构建;b,小鼠骨髓原代HSPCs和MSCs在微支架阵列芯片中共培养比例的优化;c,由HSPCs、MSCs和微支架组成的仿生微环境Microniche;d,Microniche作为整体递送至骨髓腔;e,骨髓造血再生,治疗严重辐射损伤
一、仿生微支架阵列芯片的构建用于HSPCs与MSCs共培养
为了方便研究三维微支架材料对干细胞的体外培养,作者基于PMMA并利用激光雕刻制作成多孔阵列孔板,并将支架材料成胶于众多的微孔中。在形成类似于商品化的24孔多孔阵列孔板后,从宏观上看,白色的圆点即为支架材料,类似于海绵样的结构,通过扫描电镜(SEM)观察,支架材料内部为三维多孔结构。利用微支架海绵样的虹吸作用,将MSCs悬液接种至阵列支架材料内,结果显示MSCs随着时间在三维阵列微支架中逐步增殖,并且在各个微支架中呈现均匀分布。接着,作者进一步验证MSCs可以在HSPCs培养基中稳定生长。此外,作者分别在二维和三维阵列芯片上进行HSPCs单独培养以及与MSCs共培养7天,采用LIVE/DEAD染色,用荧光显微镜表征细胞活性。结果显示在二维条件下,随着培养时间增长HSPCs单独培养以及与MSCs共培养均维持着较高的细胞活性。有趣的是,在三维条件下,HSPCs在多孔阵列中单独培养增殖较慢,只有在MSCs存在的条件下,才可以稳定生长并维持着较高的细胞活性。由此表明HSPCs体外3D培养需借助于MSCs的滋养支持(图2)。
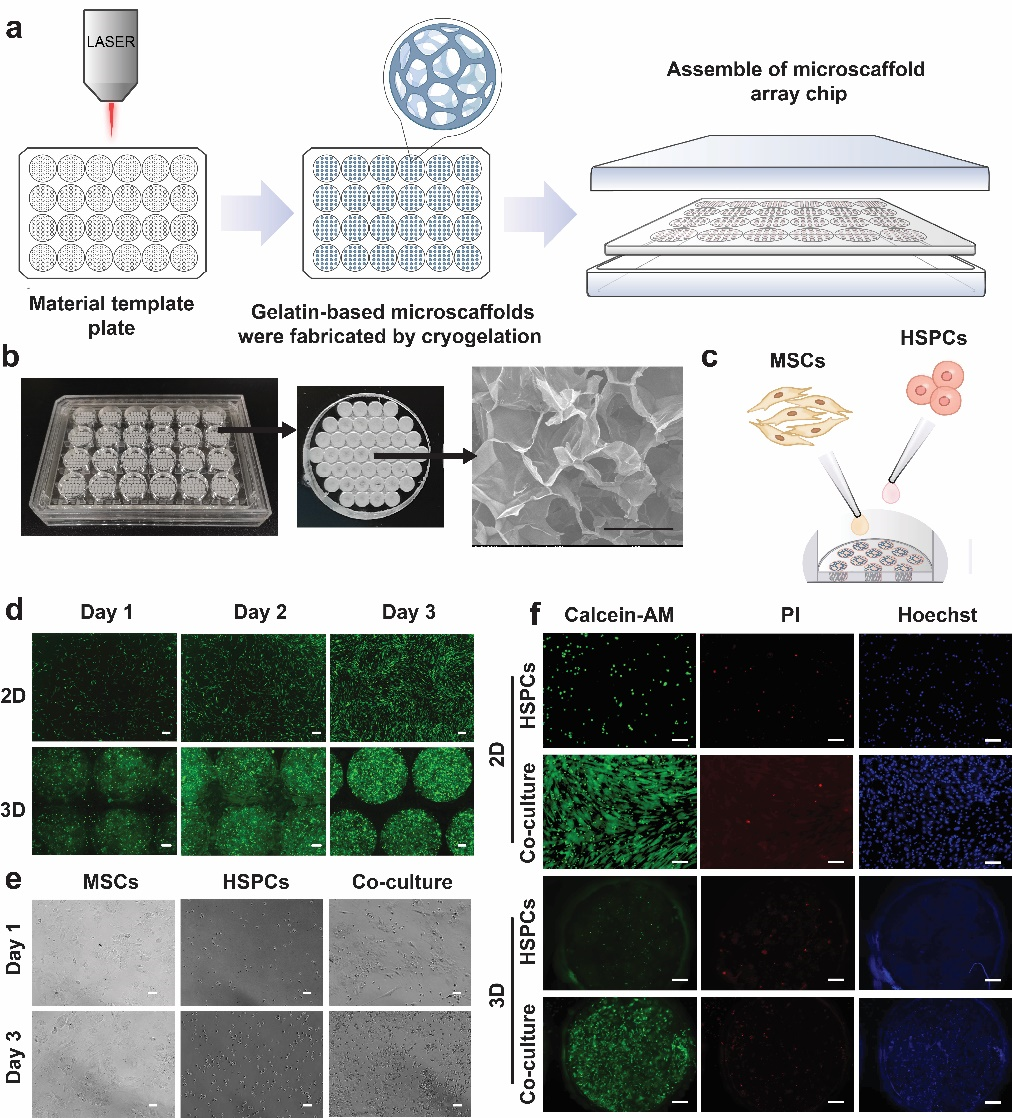
图2:仿生微支架的构建以及HSPCs与MSCs共培养. a, 微支架阵列芯片合成工艺示意图; b, 微支架阵列芯片的宏观实物图和多孔微支架微观孔径SEM成像;c,细胞共培养接种示意图;d,MSCs在微支架阵列芯片中培养;e,在造血干细胞培养基中培养MSCs以及共培养;f,HSPCs与MSCs共培养活性的表征
二、骨髓腔注射前对仿生微环境的表征
在骨髓腔注射前,作者对体外构建的微环境进行表征,以明确细胞在体外的生长状态。作者在仿生微支架材料上培养了8-12周龄的C57BL/6-CD45.1小鼠骨髓HSPCs和MSCs,通过扫描式电子显微镜(SEM)观察了三维多孔微支架内HSPCs的分布状况,如图3所示,HSPCs在二维和三维条件下与MSCs有比较密切的细胞接触。接着作者通过LIVE/DEAD染色对细胞在Microniche里的活性进行检测,结果显示微支架材料内HSPCs和MSCs活性良好。另外,在骨髓腔移植前,采用流式分析HSPCs在Microniche里的比例并计算出各门细胞具体数目,结果表明三维共培养能够显著提高体系内HSPCs (Lin-c-Kit+Sca-1+) 和HSCs (Lin-c-Kit+Sca-1+CD150+CD48-)的数量(图3)。
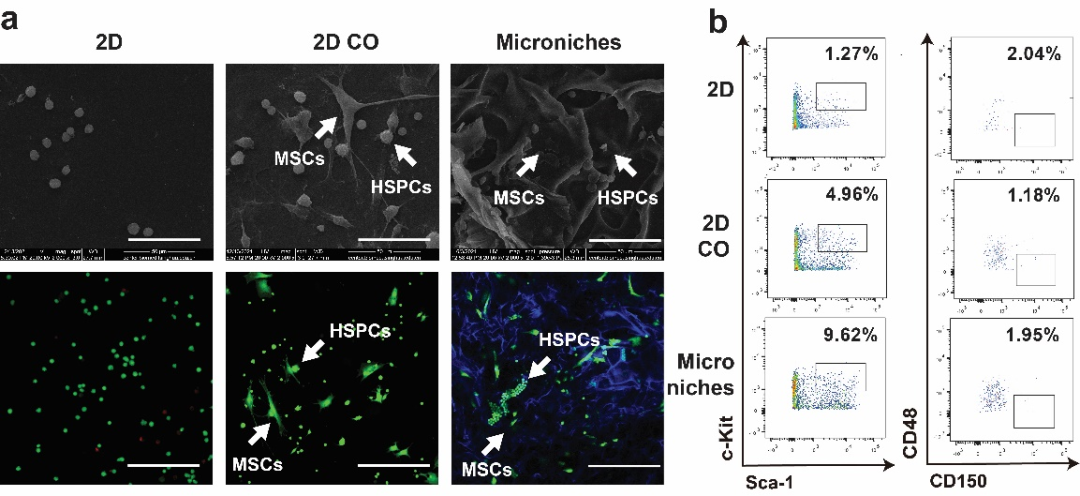
图3:Microniche体外表征。a,细胞共培养的扫描电镜表征和细胞三维共培养后激光共聚焦显微镜成像;b,仿生微环境的流式表征
三、骨髓腔移植最低剂量HSPCs治疗严重的h-ARS,促进外周血恢复
为了验证Microniche是否能够促进致死剂量辐照小鼠的造血重建以及探究最低的HSPCs剂量。首先,作者通过静脉注射移植5000、2500、1000和500个HSPCs,发现1000个HSPCs移植后小鼠的存活率不能达到半数致死量以上,被认为是通过尾静脉不能拯救小鼠的剂量,因此,采用1000个HSPCs的剂量水平进行骨髓腔移植试验。在仿生微支架材料上培养了8-12周龄的C57BL/6-CD45.1小鼠骨髓HSPCs(500个)和间充质干细胞(10000个)1天后。随后将小鼠分为4组,分别为对照(PBS)、游离2D MSC组(2D MSCs)、3D MSCs组(3D MSCs)、游离2D 1000HSPCs细胞组(2D)、游离2D coculture细胞组(2D co)和3D coculture仿生微环境组(3D co),通过骨髓腔注射方式移植到经过致死剂量照射(9Gy)的8周龄C57BL/6-CD45.2小鼠胫骨内,移植后统计死亡率,同时每2周进行血常规检测以及流式分析外周血重建效果。有趣的是,PBS组和2D组的所有小鼠均在3周内死亡,单独移植MSCs或接种MSCs的微支架也不能挽救致命辐射的小鼠,而共培养组(2D co、Microniche)可以有效的缓解死亡率。为了进一步探究Microniche血液重建效果,作者通过流式细胞术分析了受体CD45.2小鼠中供体细胞(源自CD45.1小鼠)的谱系分化以及嵌合率。结果发现Microniche组供者嵌合率显著提高,同时促进B细胞和巨核细胞(MK)重建。一致地,血常规分析结果显示Microniche显著提高辐照小鼠的全血细胞和外周血淋巴细胞。此外,Microniche在移植4周后受体鼠血小板重建显著提高,与巨核细胞重建的流式分析结果一致。
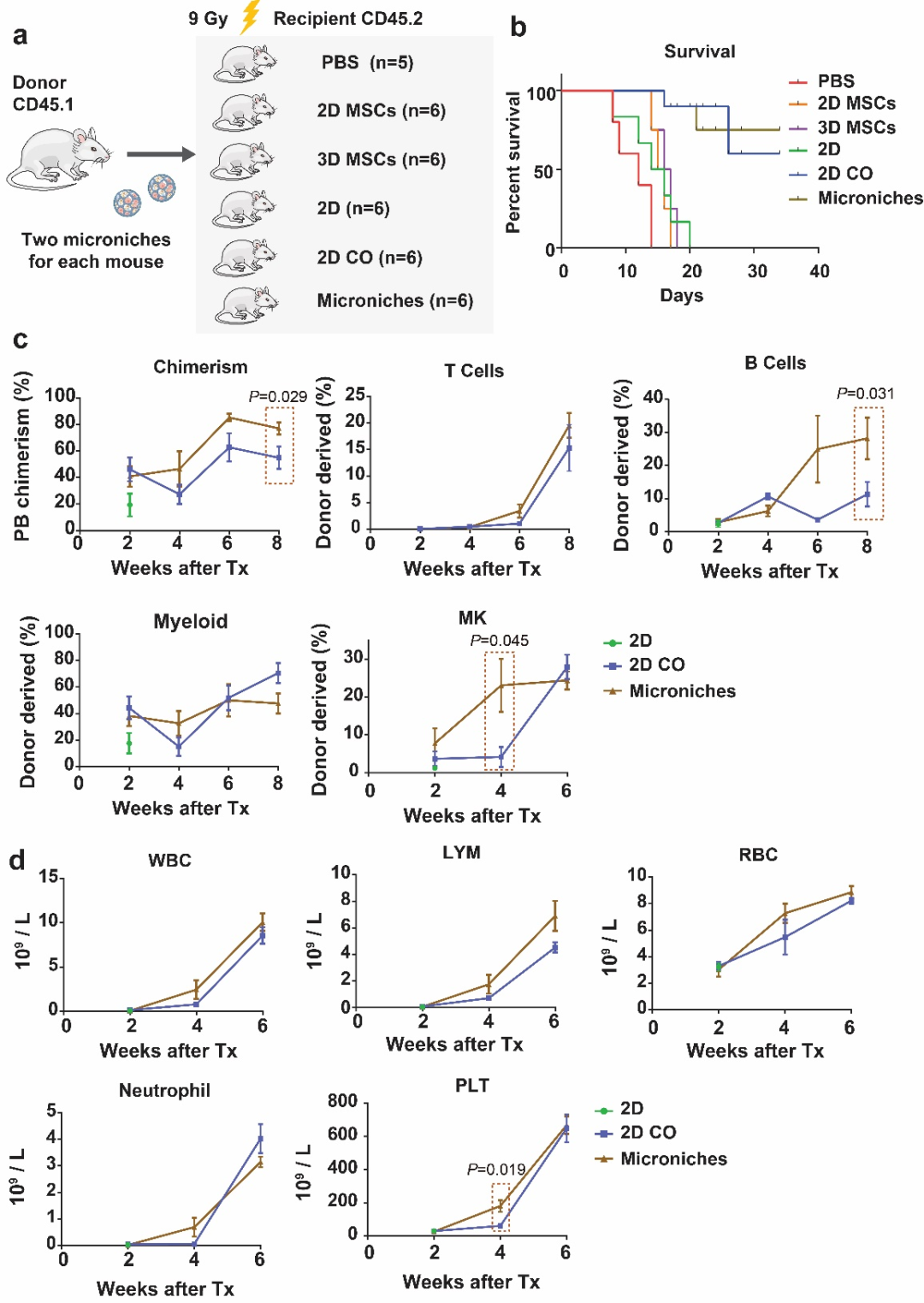
图4:含低剂量HSPCs的Microniche促进造血重建。a,动物分组及处理的流程示意图;b,生存曲线;c,CD45.2受体鼠中供体(CD45.1)谱系分化的流式细胞术分析;d,受体鼠尾静脉的血常规分析
最后作者指出,在临床上脐带血HSPCs移植不仅面临中性粒细胞和血小板植入缓慢的问题,而且还受到脐血HSPCs数量低的限制。因此,本研究采用致死剂量辐照小鼠模型筛选得到最低剂量的HSPCs,并通过骨髓腔递送的方式将Microniche作为整体递送至骨髓腔治疗h-ARS,力争在上述问题上有所突破。本研究中开发的骨髓微环境Microniche和递送方式可以辅助HSPCs快速定植骨髓发挥造血重建功能,暗示未来会潜在地减少人脐带血CD34+ HSPCs的移植使用量从而达到重建造血系统的临床目的,在脐带血CD34+ HSPCs数目有限的情况下实现一袋脐血可以治疗更多的受辐照患者。同时,Microniche可以促进小鼠h-ARS模型中淋巴细胞和血小板的重建,进而为HSPCs移植治疗血液疾病和免疫疾病的提供一种创新的临床治疗策略。
2. 论文第一/通讯作者简介
第一作者:梁海威
清华大学医学院、清华北大生命联合中心2019年进站博士后。从事造血干细胞体外仿生微环境构建的研究工作。参于国自然重点项目、国自然课题研究基金、中国-以色列国际合作项目基金,申请专利4项,授权2项,近年来以第一作者身份发表4篇国际期刊(SCI)论文。
通讯作者:朱小玉
医学博士,主任医师,博士生(博士后)导师,中国科学技术大学附属第一医院(安徽省立医院)血液科行政主任,中科大血液和细胞治疗研究所副所长。
主要从事造血干细胞移植尤其是脐血移植(Umbilical cord blood transplantation, UCBT)的基础和临床研究工作。长期致力于UCBT治疗恶性血液病技术体系优化及相关机制研究,紧密结合临床实际需求,旨在进一步提高UCBT疗效,造福更多血液病患者。安徽省学术技术带头人后备人选,安徽省第九批“特支计划”卫生创新领军人才,安徽省第一届卫生健康杰出人才。中国医师协会血液科医师分会第五届委员会委员。中华医学会血液学分会造血干细胞移植学组委员。中国抗癌协会血液肿瘤专业委员会委员。安徽省血液学分会第八届委员会副主任委员。北京癌症防治学会造血干细胞移植专业委员会副主任委员。主持国家自然科学基金3项,省部级课题3项,科大新医学重要方向1项,青年创新项目1项。近年来以第一/通讯作者在Blood, Blood Advances, Am J Hematol等发表SCI论文10余篇。
通讯作者:杜亚楠
清华大学医学院长聘教授,清华北大生命联合中心研究员,博士生导师。
主要在“微组织工程”这一特色交叉研究方向进行创新探索,实现理论探究和技术转化。团队开发的3D微组织技术,可作为新一代干细胞药物的扩增制备平台和药剂学递送系统革新再生医学;并通过构建体外仿生病理微组织模型首次报道了肝窦毛细血管化可通过胶原纤维介导的“旁张力信号”促进肝脏纤维化的全新病理机制,为治疗组织纤维化促进组织再生提供了新手段。微组织工程技术已实现商品化,相关产品获得美国FDA和中国药监局首款细胞药用辅料资质并获得29届日内瓦国际发明金奖,获得第二十四届中国科协求是杰出青年成果转化奖。主持国家自然科学基金杰青项目、国家自然科学基金优青项目、北京市自然科学基金杰青项目,并获得教育部青年长江学者称号。近年来共发表高影响力SCI论文100余篇 (发表在Nature Materials, Nature BME, Nature Communications, PNAS, Science Advances 等杂志),批准授权专利20余项。
课题组主页:http://dulab-tsinghua.net/
3. 资助信息
该研究获自然科学基金杰青项目(82125018)、北京市科学技术重点支持项目(Z181100001818005)和清华北大生命联合基金的支持,并得到了清华大学药学院王建伟研究员的支持与帮助。
4. 原文信息
Liang H, Ao Y, Li W, Liang K, Tang B, Li J, Wang J, Zhu X*, Du Y*.
Injectable bone marrow microniches by co-culture of HSPCs with MSCs in 3D microscaffolds promote hematopoietic reconstitution from acute lethal radiation.
Bioactive Materials, 22 (2023) 453-465.
原文链接:
DOI:https://doi.org/10.1016/j.bioactmat.2022.10.015

